Chimie Inorganique
Complexes de fer, catalyseurs d'oxydation bioinspirés
Axe 3 — INSERTION DES CATALYSEURS DANS DES SYSTEMES SUPRAMOLECULAIRES ET EFFETS DE SECONDE SPHERE
Les objectifs de ces travaux sont l'amélioration des catalyseurs en terme de sélectivité et efficacité.
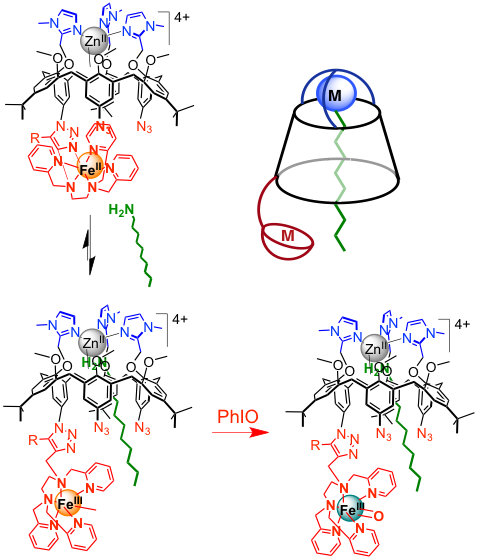
En s'inspirant de la seconde sphère de coordination des métalloenzymes qui fixe le substrat dans la poche enzymatique et permet sa transformation avec efficacité et sélectivité, nous avons développé un nouveau système dans lequel l'unité catalytique (complexe de fer) est couplée de manière covalente à un module de reconnaissance du substrat (cavité calixarène coiffée par 3 imidazoles pour complexer un ion ZnII). Ce projet a été effectué en collaboration avec l'équipe du Pr. O. Reinaud (Univ. Paris Descartes). L'étude détaillée de la chimie de coordination de ce ligand hétéroditopique a permis de démontrer comment localiser à la fois le ZnII dans le site tris(imidazole) et le FeII dans le ligand aminopyridine. L'encapsulation, au sein de la cavité calixarène, d'une molécule organique (alkylamine linéaire de longueur variable : C7-C12) qui se lie au ZnII a été observée. Des intermédiaires réactionnels FeIVO et FeIII(OOH) ont été identifiés. De manière intéressante, l'amine encapsulée induit un switch de coordination du fer et promeut la formation du FeIVO, mimant ainsi l'effet allostérique bien connu dans les métalloenzymes.
Dans le même ordre d'idée, il est possible de développer des métalloenzymes artificielles par couplage covalent d'un complexe dans une protéine.
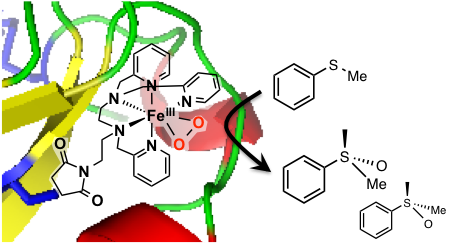
La ß-lactoglobuline est une protéine commerciale bon marché qui possède une cystéine libre que nous avons ciblé pour ancrer un complexe (ANR Cathymetoxy, collaboration avec le Pr. J.-P. Mahy, ICMMO). Le biohybride, schématisé ci-contre, a été synthétisé et caractérisé en détail par spectroscopie. Son utilisation en catalyse d'oxydation du thioanisole par l'eau oxygénée révèle la formation de sulfoxyde avec un excès énantiomérique de 20% dû à l'environnement spécifique créé autour du centre métallique par la protéine. Un intermédiaire FeIII(OO) compétent pour l'oxydation du substrat a été identifié. Ce résultat constitue le deuxième exemple d’intermédiaire réactionnel oxydant identifié dans une métalloenzyme artificielle.
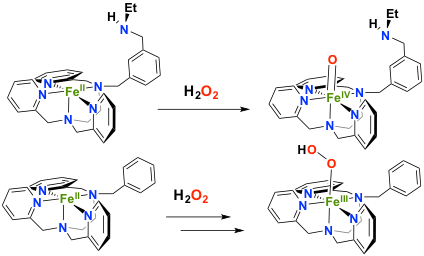
Des systèmes plus simples peuvent être élaborés en introduisant des groupements polaires en seconde sphère de coordination du centre métallique dans le but de moduler la densité électronique des intermédiaires réactionnels Fer-oxygène. Cet effet, assuré par des acides aminés de seconde sphère dans les métalloenzymes, est connu sous le nom d'effet "pull". De cette manière, nous avons modifié drastiquement la réactivité d'un complexe de FeII vis à vis de H2O2. En présence d'une amine non coordinante en seconde sphère, une conversion directe du FeII en intermédiaire FeIVO est observée, alors qu'une espèce FeIII(OOH) est observée en absence de ce groupement (collaboration avec le Dr F. Avenier, ICMMO). L’amine seconde sphère joue ainsi le même rôle de relais de protons que l’histidine présente dans la poche des peroxydases.
Dernière mise à jour le 13.11.2019

